Einleitung
Das Verständnis um die physiologische Funktion der Extremitäten ist eine wesentliche Voraussetzung zur Behandlung von Erkrankungen des Bewegungsapparates. Dabei wird landläufig davon ausgegangen, dass in der Biomechanik, ähnlich wie in der Anatomie bereits seit Langem das Wesentliche bekannt ist. Doch gerade am Fuß ist das Wissen um die Funktion teilweise noch unbefriedigend oder nicht umfassend vorgedrungen. So wird in aktuellen orthopädischen Lehrbüchern noch das Quergewölbe des Fußes beschrieben, das „im Bereich der Metatarsaleköpfchen lokalisiert“ ist (Niethardt et al. 2009) und das Abflachen dieses Quergewölbes als ursächlich für den Spreizfuß definiert (Imhoff et al. 2006) auch wenn bereits H. Virchow 1883 die Theorie vom „vorderen Quergewölbe“ ablehnte und vom: “... vergiftenden Einfluss“ sprach, “ den die althergebrachten Phrasen von Stützpunkten und Fußgewölbe auf ganze Generationen von Ärzten ausgeübt haben.” Aber auch gängige Theorien, wie das „2-Säulenprinzip des Fußes“, werden hinterfragt. Somit soll dieser Beitrag dazu dienen, einen Überblick über das aktuelle Verständnis der Biomechanik des Gehens und Stehens zu geben. Einen Schwerpunkt bildet dabei die Funktion des Fußes.
Prinzipiell ist der ganze Körper am bipedalen Stehen, Laufen und Gehen beteiligt. Die unteren Extremitäten müssen dabei vor allem Last aufnehmen und umsetzen, um das Gleichgewicht zu halten und eine Fortbewegung zu ermöglichen. Daher ist die untere Extremität vor allem auf Stabilität und weniger auf ein hohes Maß an Beweglichkeit ausgelegt. Hierzu dienen insbesondere statische Elemente wie Knochen und Gelenke mit großen Artikulationsflächen und stabilen Bandverbindungen.
Stehen, Gehen und Laufen

Der Mensch ist als „dynamisches Wesen aufgebaut“, weshalb längeres Stehen allgemeinhin als unangenehm empfunden wird und somit mitunter als Disziplinierungsmaßnahme oder sogar Folter genutzt wird. Das zweibeinige Stehen erfordert eine andauernde, zumeist unterbewusste Regulation, deshalb wird dem regungslosen Stehen in der Regel das Sitzen oder Umherlaufen vorgezogen. Auch das Gehen und Laufen wird weitgehend unterbewusst gesteuert, wobei in der Regel auf einen möglichst geringen Energieverbrauch geachtet wird (Inman et al. 1981). Dies entspricht beim Gehen bei Erwachsenen einer durchschnittlichen Schrittlänge von 0,6 bis 0,7 m und einer durchschnittlichen Schrittfrequenz von 100 bis 130 Schritten/Minute bei einer Geschwindigkeit von 1,2 bis 1,5 m/sec. Bei Geschwindigkeitsänderungen im Gehen nehmen Schrittlänge und Schrittfrequenz proportional zu bzw. ab (Kramers-de Quervain et al. 2008). Die Höchstgeschwindigkeit des Gehens ist dabei durch die Beinlänge limitiert. Eine Verlangsamung des Gehens unter 80 Schritte/min verhindert einen flüssigen Gangzyklus (Kramers-de Quervain et al. 2008).
Ein Gangzyklus ist definiert als die Bewegung zwischen dem Aufsetzen der Ferse eines Fußes und dem erneuten Fersenaufsatz desselben Fußes (Doppelschritt).
Der Gangzyklus wird aus einer Stand- (ca. 62%) und einer Schwungphase (ca. 38%) gebildet.
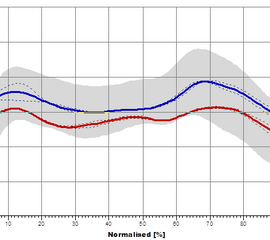
Die Standphase (Abbildung 1) beginnt mit dem Aufsetzen der Ferse und endet mit dem Abheben des selben Fußes. Während dieser Phase kommt es zum zweimaligen Zweibeinstand (zwischen 0% und 12% und 50% bis 62% des Gangzyklus) und einer Periode des Einbeinstandes (12% bis 50% des Gangzyklus). Die Standphase wird weiter unterteilt in:
- Initiale Kontaktphase
- Belastungsantwort/Stoßdämpfungsphase
- Mittlere Standphase
- Terminale Standphase
- Vorschwungphase
Die Schwungphase ist die Phase ohne Belastung. Dieser Teil des Gangzyklus beginnt mit dem Abheben der Großzehe vom Boden und endet vor dem Berühren des Bodens mit demselben Fuß. Die Schwungphase besteht aus 3 Phasen:
- Frühe Schwungphase oder Beschleunigungsphase
- Mittlere Schwungphase
- Terminale Schwungphase oder Verzögerungsphase
Eine Einteilung des Ganges und der Bewegungsgrade der beteiligten Gelenke ist in Tabelle 1 dargestellt.
| Phasen des Gehens | Bereich des Gangzyklus (Circa-Angaben in %) |
Beginn | Hüfte | Knie | Tibia | Oberes Sprunggelenk | Unteres Sprunggelenk | Metatarsalgelenke | ||
| Initialkontakt | 0 | Bodenkontakt der Ferse | 20- 35° Flexion | ca. 5° Flexion | Außenrotation | Neutral bis leichte Plantarflexion | Inversion | |||
| Belastungsantwort | 0-10 | Fuß flach am Boden | ca. 20° Flexion | 15°-25° Flexion | Innenrotation | 15° Plantarflexion | Eversion | |||
| Mittlere Standphase | 10-30 | Abheben des kontralateralen Fußes | Bewegungsumkehr in Extension | ca. 5° Flexion | Innenrotation | Neutral | Eversion | |||
| Terminale Standphase | 30-50 | Körperschwerpunkt direkt über Fuß | ca. 20° Extension Innenrotation Abduktion | Extension | Außenrotation | Dorslextension (bis 10°) | zunehmende Inversion | |||
| Vorschwungphase | 50-60 | Initilakontakt der Gegenseite | ca. 10° Extension | 35-40° Flexion | Außenrotation | 15-20° Plantarflexion | Inversion | |||
| Frühe Schwungphase | 60-75 | Abstoßen der Zehen | 15-20° Flexion | 60-70° Flexion | 5-10° Plantarflexion | Neutral | bis 60° Dorsalextension | |||
| Mittlere Schwungphase | 75-85 | Maximale Kniefektion | 25-30° Flexion | 60-70° Flexion | Vertikal | Neutral | Neutral | Neutral | ||
| Terminale Schwungphase | 85-100 | Tibia vertikal | 25-30° Flexion | Extension | Neutral | Neutral | 0-25° Plantarflexion |
Beim Laufen verkürzt sich der Bodenkontakt. Eine Geschwindigkeitszunahme wird hier, wie auch beim Gehen durch eine Zunahme von Schrittlänge und Frequenz erzeugt, wobei beim Laufen die Schrittfrequenz allerdings überproportional zunimmt. Die Zweibeinstandphasen werden durch 2 „Flugphasen“ ersetzt.
Arme und Stamm
Während des Initialkontaktes ist der Stamm zur Gegenseite rotiert, der gegenläufige Arm zeigt nach vorn, der gleichseitige Arm zurück und das Körpergewicht wird auf das Standbein verlagert. Der M. erector spinae ist aktiv. In der mittleren Standphase sind dann die Arme parallel und der Stamm befindet sich in einer Neutralposition. Zum Ende der Standphase rotiert der Stamm dann zur selben Seite.
Das Becken

Während das Becken in der Frontalebene einer Brücke gleicht, die auf 2 Pfeilern (den Femurköpfen) ruht, ist die Stabilität in der Sagittalebene deutlich herabgesetzt und bedarf daher passiver (fascialer) und aktiver (muskulärer) Stabilisatoren. Video 1 veranschaulicht die Bewegungen des Beckens während des Gehens (Video 1, Abbildung 2).
Video 1
Video:1: Dr. med. Christina Müller, Hardy Hauk, Lehrstuhl für Orthopädie der Friedrich-Schiller-Universität, Jena
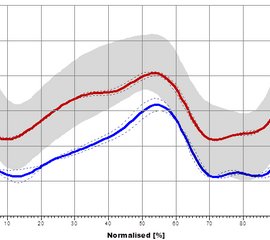
In der Sagittalebene beträgt die physiologische Beckenkippung 5 bis 20°. Diese Kippung nimmt mit zunehmender Laufgeschwindigkeit zu. In der Sagittalebene kann zudem eine Translationsbewegung (Ante- oder Retropulsion) erfolgen (Abbildung 3).
In der Frontalebene zeigt sich während des Gehens/Laufens ein „physiologisches Trendelenburgphänomen“. Es kommt beim Auftreten zu einem Absinken und während der Schwungphase zu einem Anheben des Beckens. Dies geschieht vor allem durch eine exzentrische (bremsende) Aktivierung der Abduktoren des Standbeines (Abbildung 4), (Klein und Sommerfeld 2004).
In der Transversalebene kommt es zu einer Vorwärtsrotation (Außenrotation in Bezug zum Standbein) der vorgehenden Seite (Abbildung 5).
Abb.3 - Abb.5: Dr.-Ing. Frank Layer, Dr. Ing. Klaus Sander (Biomechanik-Labor des Lehrstuhls für Orthopädie der Friedrich-Schiller-Universität Jena)
Die Hüftgelenke
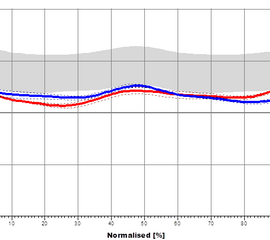
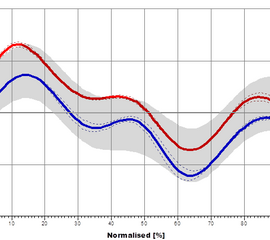
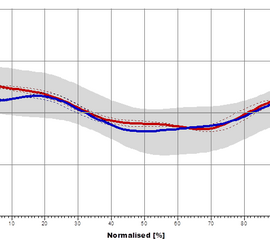
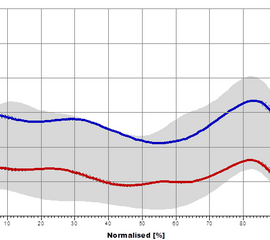
Das Hüftgelenk kommt im Wesentlichen einem idealen Kugelgelenk gleich. Die Belastung entspricht dem Mehrfachen des Körpergewichts, scheint sich aber für das Standbein im Gehen nicht merklich von der Belastung im Einbeinstand zu unterscheiden (Kummer 2005). Es setzen sowohl ein- als auch zweigelenkige Muskeln an, deren Funktion sich je nach Gelenkstellung deutlich ändern kann. Während des Gangzyklus erfolgen Bewegungen in Extension / Flexion (Abbildung 6), Abduktion / Adduktion (Abbildung 7) und Rotationsbewegungen (Abbildung 8). In der Initialphase werden die Extensoren isometrisch (haltend) aktiv um ein Einklappen des Stamms zu verhindern (Engl. Jackknifing= „Taschenmessern“). Im weiteren Verlauf kommt es durch eine zunehmend konzentrische (verkürzende) Kontraktion der Extensoren zu einer Bewegungsumkehr, während der mittleren Standphase erfolgt so die Hüftextension. Dieser Richtungswechsel erfolgt mit Bodenkontakt der Gegenseite in der Vorschwungphase. Zum Ende der Standphase kommt es zu einer Hyperextension, die Hüftextensoren arbeiten nun isometrisch (haltend) und die Flexoren exzentrisch (bremsend). Die Flexion zu Beginn der Schwungphase erfolgt durch eine konzentrische Aktivität der Flexoren. Zum Ende der Schwungphase kommt es dann zu einer exzentrischen Aktivierung der Extensoren.
Abb.6 - Abb.8: Dr.-Ing. Frank Layer, Dr. Ing. Klaus Sander (Biomechanik-Labor des Lehrstuhls für Orthopädie der Friedrich-Schiller-Universität Jena)
Die Kniegelenke
Hier artikulieren distaler Femur, Tibiakopf, Fibulakopf und Patella. Das Kniegelenk besitzt im Wesentlichen 2 (Drehbewegungs-)Freiheitsgrade nämlich die Extension- Flexion (Abbildung 9) und vor allem in Beugung die Rotation (Abbildung 10), es finden aber auch assoziierte Verschiebungen statt (Zug-Druck, anterior-posterior, Varus-Valgus) (Abbildung 11). Die Beugung des Knies wird näherungsweise als Drehgleiten oder Rollgleiten beschrieben was einer Kombination aus Abrollen und Gleiten entspricht. Zum Ende der Extension erfolgt eine Außenrotation (die so genannte Schlussrotation), (Kummer 2005). Die Gelenkkongruenz ist eingeschränkt, so dass discoligamentäre Strukturen eine wesentliche Rolle bei der Stabilisierung spielen.
Während des Initialkontaktes ist das Knie nur leicht gebeugt und dient als Kraftabsorber. Es erfolgt eine weitgehend passive und geschwindigkeitsabhängige Flexion von bis zu 40° beim Laufen. Dazu arbeiten die Extensoren (v.a. M. Quadrizeps) in dieser Phase exzentrisch (bremsend). Während der mittleren Standphase kommt es zur Bewegungsumkehr in Richtung Extension. Dies geschieht vor allem indem die Kraftlinie vor das Knie fällt. Die Quadrizepsaktivität nimmt hier rasch ab. Das Knie „blockiert“ in Extension. Im Einbeinstand, während der terminalen Standphase, wird der M. Gastrocnemius aktiviert und stabilisiert Knie und Sprunggelenk. In der Vorschwungphase wird das Knie zusammen mit Hüfte und Sprunggelenk flektiert. Der M. Quadrizeps wird lediglich exzentrisch (bremsend) aktiv. In der frühen Schwungphase wird die maximale Beugung erreicht. Der M. Quadrizeps ist weiter exzentrisch (bremsend) aktiv. In der mittleren Schwungphase kommt es zu einer schnellen konzentrischen (verkürzenden) Aktivierung des M. Quadrizeps um den Unterschenkel zu beschleunigen. Gegen Ende der Schwungphase wird die Streckung durch die ischiokrurale Muskulatur gebremst. Als „Landungsvorbereitung“ werden Beuger und Strecker aktiviert um das Gelenk zu stabilisieren.
Abb.9 - Abb.11: Dr.-Ing. Frank Layer, Dr. Ing. Klaus Sander (Biomechanik-Labor des Lehrstuhls für Orthopädie der Friedrich-Schiller-Universität Jena)
Fuß und Sprunggelenk

Der Fuß kann als Wurzel des aufrechten, zweibeinigen Gangs gesehen werden. Er besteht aus zahlreichen Gelenken und wird von 57 Muskeln gesteuert. Dieses Zusammenspiel ist bis heute nicht abschließend geklärt. So gilt weiterhin das Zitat von Georg Hohmann aus seinem Buch „Fuß und Bein“ (1951): „ Der menschliche Fuß ist eine Kunstform der Natur. Seinem Wesen nach ist er noch nicht völlig erkannt und erklärt und es bedarf noch mancher wissenschaftlichen Forschung, bis dieses Gebilde in seiner Wesenheit völlig klar ist.“
Am Fuß findet eine dreidimensionale Bewegung statt. Diese kann in einzelne Elemente aufgeteilt werden die sich um ein dreiachsiges Koordinatensystem ergeben. Zentrum dieser Achsen ist nicht der Körper, sondern der Fuß selbst. Die Aufteilung der Bewegungsachsen und Komponenten wird in Tabelle 2 und Bild 12 dargestellt.
| Achse | Bewegung | |
|---|---|---|
| X | Pronation bzw. Valgisierung (Engl. Eversion) | Supination bzw. Varisierung (Engl. Inversion) |
| Y | Abduktion | Adduktion |
| Z | Dorsalextension | Platarflexion |
| Summe | => Eversion | => Inversion |
Zur Vereinfachung sollen nachfolgend die biomechanischen Eigenschaften der verschiedenen anatomischen Strukturen im Einzelnen beschrieben werden.
Näherungsweise kann von einer statischen und einer dynamischen Führung ausgegangen werden. Die statische Stabilisierung erfolgt über Bänder und Kapseln. Dabei erhält die ligamentäre Verspannung die Skelettform des Fußes auch ohne Muskulatur 1. Die plantaren Bänder und die Plantarfaszie bilden die horizontale Zugverstrebung und gleichen nach Lapidus dabei einem Fachwerkhaus, wobei die Kraft über 2 Stäbe vom Talus eingeleitet wird und die Querverstrebungen dabei einen Kollaps verhindern (Lapidus 1943).
Die Biomechanik des Bandapparats
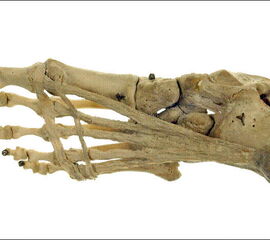
Die Plantarfaszie oder Plantaraponeurose spannt sich wie die Sehne eines Bogens zwischen Kalkaneus und Metatarsaleköpfen auf. Im Bereich der MTP-Gelenke vereinigt sich die Aponeurosis plantaris mit den Gelenkkapseln zur Plantarplatte (Abbildung 13). Die Festigkeit der Plantarfaszie wird mit 200-250 N/mm² angegeben und zeigt sich medial deutlich stärker 2. Durch die Verspannung wird die vom Talus eingeleitete Kraft auf die Fußsohle übertragen, ein Kollaps des Längsgewölbes wird verhindert und die Biegelast auf die Metatarsalia wird reduziert.
Der Windlass-Mechanismus (Ankerwinden-Mechanismus) wurde durch Hicks beschrieben und gilt als stärkster Stabilisator des Längsgewölbes 3. Dabei wird durch eine passive Dorsalextension der Zehen während des Abstoßens die Plantaraponeurose und die Sehnen der Fußflexoren über die Metatarsaleköpfe gezogen und weiter verspannt und die Biegelast weiter in eine Kompressionsbelastung umgewandelt (Abbildung 14). Zudem wird der Kalkaneus invertiert. Dieser Mechanismus wurde dem Wickeln einer Schnur (Planataponeurose und Sehnen) um eine Windentrommel (Metatarsaleköpfchen) gleichgesetzt. Der Windlass-Mechanismus scheint umso effizienter je mehr die Ausrichtung von Sesambeinen und Metatarsale I der Richtung der Plantaraponeurose entspricht 4.

Es wird ebenso von einem „Reversed Windlass-Mechanismus“ ausgegangen: 5 . Während des Aufsetzens des Fußes kommt es zu einer Innenrotation der Tibia und damit verbunden zu einer Eversion des Kalkaneus, was zu einer Abflachung des Längsgewölbes und damit zu einer Kompression des Fußskelettes führt, um den Fuß für den Auftritt zu stabilisieren und vor allem vor exzessiver Pronation zu schützen. Im weiteren Verlauf kommt es dann am Ende der Standphase zu einer Außenrotation der Tibia und Supinationsbewegung was wiederum zu einer Entspannung der Plantarapponeurose führt. Im weiteren Gangzyklus folgt dann erneut der Windlass-Mechanismus. Beide Mechanismen sind nicht abschließend verstanden und daher weiter Gegenstand intensiver Debatten.
Das Pfannenband (Ligamentum calcaneonaviculare plantare, „Plattfußband“, engl.: spring ligament) bildet eine faserknorpelige Gelenkfläche, die gemeinsam mit dem Calcaneus und dem Os naviculare eine Pfanne für den Taluskopf („Coxa pedis“) bildet. Nach Davis et al. besteht dieser Bandkomplex im Wesentlichen aus zwei funktionellen Einheiten (superomediales calcaneonaviculares Ligament und inferiores calcaneonaviculares Ligament) und fungiert wie eine „Schlinge“ oder „Schleuder“ um den Taluskopf 6. Es schränkt die mediale oder plantare Auslenkung des Taluskopfes ein. Dies erfolgt im Zusammenspiel mit der Sehne des M. tibialis posterior 6. Dabei werden Talusbewegungen soweit zugelassen, dass die mechanische Kette der Fußwurzel geöffnet oder geschlossen werden kann (siehe Chopart-Gelenk).

Die Funktion des Ligamentum calcaneocuboideum plantare (Ligamentum plantare longum, „langes Sohlenband“) (Abbildung 15) wurde von Huson beschrieben. Es verhindert ein plantares Ausbrechen des Kalkaneus während des Auftritts und wird dabei stark belastet. Weiterhin erlaubt es dem Cuboid ein plantares Wegrutschen während es dessen Bewegung nach dorsal begrenzt (Huson 1965).
Das Ligamentum talocalcaneum interosseum besteht im Wesentlichen aus dem Ligamentum colli und dem Ligamentum canalis tarsi. Diese Bänder besitzen die höchste Dichte von Propriorezeptoren im gesamten Körper. Ihre Funktion ist noch nicht restlos verstanden, wobei biomechanisch gezeigt wurde, dass die Kinematik des oberen und unteren Sprunggelenks bei durchtrenntem Band nachhaltig gestört ist und es zu einer anterolateralen Rotationsinstabilität im OSG kommt 7. Weiterhin dient es der Verbindung und Stabilisierung des USG und scheint einer Pronation sowie einem anterioren Abgleiten des Calcaneus entgegen zu stehen 8910.
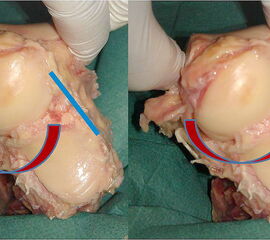
Das Zervikale Band (cervical ligament) wird gelegentlich dem Ligamentum talocalcaneum interosseum zugeschrieben, verläuft aber außerhalb des Sinus tarsi. Es entspringt vom Kalkaneus anteromedial vor dem Sinus tarsi und setzt am inferoren Talushals an. Es gilt als stärkstes,den Talus und Calcaneus verbindendes Band. Biomechanisch konnte gezeigt werden, dass es in allen Bewegungsrichtungen das Subtalargelenk stabilisiert 10. Das Band führt die Bewegung des Talushalses über dem Calcaneus in „scheibenwischerartigen Bewegungen“ (Abbildung 16), (Klein und Sommerfeld 2004).

Die Bänder des oberen und unteren Sprunggelenks sind kräftig ausgeprägt und wichtige Stabilisatoren des Rückfußes.
Vom Innenknöchel ausgehend finden wir das so genannte Ligamentum deltoideum (Ligamentum collaterale mediale, Deltaband), dessen vier Teile, welche an Os Naviculare, Talus und Calcaneus ansetzen, sind präparatorisch schwer abzugrenzen. Dieses Band limitiert die Talusabduktion und stabilisiert das obere Sprunggelenk bei Außenrotation, Pronation und Plantarflexion sowie das untere Sprunggelenk bei Außenrotation und Valgustress.
Das Ligamentum talofibulare anterius, das in Neutralstellung des OSG fast horizontal von der Fibulaspitze an den Talushals verläuft und als einziges Band ausschliesslich das OSG stabilisiert (Abbildung 17). Das Ligamentum calcaneofibulare verläuft parallel zur Gelenkachse des USG und gerät daher bei Bewegungen in diesem Gelenk kaum unter Spannung. Es überspannt oberes und unteres Sprunggelenk und verläuft in einem ca. 120° Winkel zum Ligamentum talofibulare anterius. Daher sind beide Bänder (Ligamentum talofibulare anterius und calcaneofibulare) bei Bewegungen im OSG zu unterschiedlichen Zeiten beansprucht. In Dorsalextension läuft das Ligamentum talofibulare anterius parallel zum Boden und kann so eine Supination kaum verhindern, während hier das Ligamentum calcaneofibulare annähernd im 90° Winkel zu dieser Bewegung steht und somit sehr wohl eine Supination verhindert. Umgekehrt verhält sich dies bei Plantarflexion was nach Stephens und Sammarco dazu führt, dass das Ligamentum talofibulare anterius nur in Plantarflexion das OSG stabilisiert 10. Daher sollte eine Stabilitätsprüfung des OSG stets in Dorsalextension und Plantarflexion erfolgen.
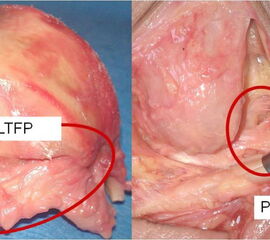
Das Ligamentum talocalcaneare laterale wird Großteils vom Ligamentum calcaneofibulare begleitet und liegt somit ebenfalls nahe der Gelenkachse des USG. Das Ligamentum talofibulare posterius läuft in Neutralstellung ebenfalls annähernd horizontal zum Boden. Es wird von Stephens und Sammarco als „letzter Kontrollzügel“ bezeichnet, da es bei ihren biomechanischen Tests das OSG vor einer Luxation bewahrt hatte, wenn das Ligamentum talofibulare anterius und calcaneofibulare durchtrennt waren. Bei Supinationsbewegungen wird dieses Band besonders belastet (Abbildung 18).
Die Bänder werden allerdings nicht nur durch Bewegungen des Fußes beansprucht, sondern übertragen auch Bewegungen vom Unterschenkel auf den Fuß. Rotiert der Unterschenkel beispielsweise während des Gehens nach außen, so spannen sich Deltaband und Ligamentum talofibulare anterius an und es kommt zu einer Abduktion des Talus 11 . Dieser Effekt ist bei Innenrotation deutlich geringer ausgeprägt und könnte für die knöcherne Verblockung beim Abstoßen (nach der Theorie von Inman) eine Rolle spielen (siehe auch oberes Sprunggelenk). 11, (Inman 1991).
Die Syndesmose stabilisiert die Sprunggelenksgabel, indem sie Tibia und Fibula verbindet. Sie besteht aus 4 Teilen (Ligamentum tibiofibulare interosseum, anterius, posterius und transversum) und erlaubt der Fibula (Minimal-) Bewegungen in allen Ebenen. Da die Talusrolle ventral deutlich breiter ist, spannt sich die Syndesmose bei Dorsalextension an, während sie bei Plantarflexion entlastet wird.
Es konnte gezeigt werden, dass das Ligamentum tibiofibulare anterius vor allem in Plantarflexion und das posterius vor allem bei Dorsalextension belastet wird 12. Das Ligamentum tibiofibulare interosseum verhindert eine Biegung der Fibula und leitet einen geringen Anteil (6-15%) der axialen Körperlast auf die Fibula 1314.
Das Lisfranc-Ligament scheint das wichtigste und stärkste Band im tarsometatarsalen Komplex zu sein 1516 Damit hat es einen entscheidenden Anteil an der Stabilisierung des zweiten Strahls und an der Kongruenz des Mittelfußes.
Die Muskeln des Fußes aus biomechanischer Sicht
Muskeln sind notwendig, um die dynamischen Kräfte beim Gehen und Stehen aufzufangen, den Fuß an Unebenheiten des Bodens anzupassen und dienen hierdurch der Erhaltung des Gleichgewichts. Es können grob fünf verschiedene extrinsische Muskelgruppen und die intrinsische Fußmuskulatur unterschieden werden (Tabelle 3).
| Muskelgruppen | Ursprung | Ansatz | Bewegung am Fuß |
|---|---|---|---|
| 1. | Lateraler Unterschenkel | Lateraler Fußrand | Plantarflexion Eversion |
| 2. | Ventraler Unterschenkel | Lateraler Fußrand | Dorsalextension Eversion oder Inversion |
| 3. | Dorsaler Unterschenkel | Medialer Fußrand | Plantarflexion Inversion |
| 4. | Ventraler Unterschenkel | Medialer Fußrand | Dorsalextension Eversion oder Inversion |
| 5. | Dorsales Bein | Rückfuß | Plantarflexion und Inversion |
Von besonderer biomechanischer Relevanz sind:
- M. tibialis posterior
- M. tibialis anterior
- M. peroneus longus
- M. peroneus brevis
- M. flexor hallucis longus
- Der Triceps surae- Komplex
Der M. tibialis posterior ist an der Plantarflexion beteiligt und zudem der Muskel mit dem größten Inversionsmoment.(Klein und Sommerfeld 2004) Ohne Umlenkung über den Innenknöchel hat er keinen Hebelarm. Er ist der Hauptstabilisator des USG gegen Rückfußvalgus und Vorfußpronation. Durch den Muskelzug wird das Chopart-Gelenk blockiert (siehe unten). Somit entsteht ein rigider Hebelarm. Der M. tibialis posterior ist ein Standphasenmuskel, der vom Fersenkontakt bis zum Abstoßen der Ferse angespannt ist und die Energieübertragung vom Fuß auf den Boden erhöht (siehe Chopartgelenk) (Video 2), 17.
Video 2: Der M. tibialis posterior bewirkt eine Supination und Adduktion des Fußes und unterstützt die Plantarflexion
Video 2: Dr. med. Christina Müller, Hardy Hauk, Lehrstuhl für Orthopädie der Friedrich-Schiller-Universität, Jena
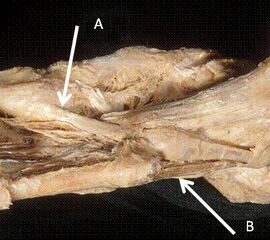
Der M. tibialis anterior beteiligt sich an der Dorsalextension des Sprunggelenks und kann sich in der Regel auch an der Inversion des Fußes beteiligen, vor allem wenn diese bereits eingeleitet wurde, zudem scheint er sich auch an der Eversion beteiligen zu können.(Klein und Sommerfeld 2004 , Sarrafian 1983) Er ist vor allem beim Auftritt der Ferse bis zum vollen Bodenkontakt aktiv um den Fuß kontrolliert abzusetzen.
Der M. peroneus longus ist ein Plantarflexor von Fuß und Metatarsale I und evertiert den Fuß (Abbildung 19). Er ist in der mittleren und terminalen Standphase aktiv und schützt vor Inversion 18 . Somit ist er ein wesentlicher Stabilisator des Sprunggelenkes. Eine Schwäche des Muskels kann zu häufigeren Distorsionen führen. Johnson und Christensen beschreiben, dass durch den M. peroneus longus vor allem eine Eversion und Plantarisierung des Metatarsale I und damit eine Verblockung zur Stabilisierung der medialen Säule generiert wird 19. Diesen Ergebnissen wiedersprechen allerdings Kokubo et al. die in einer biomechanischen Arbeit zeigten, dass sich durch seine Kontraktion die Fußsteifigkeit verringerte 17 . Somit scheint nach den Ergebnissen dieser Arbeitsgruppe der M. peroneus longus der Energieabsorption beim Auftreten und der Stabilisierung beim Stand zu dienen 17. Dieser Funktion wiederspricht allerdings, nach Meinung der Autoren, die Aktivierungszeit des Muskels gegen Ende der Standphase, da hierbei eine Stabilisierung des Längsgewölbes eintritt.
Der M. peroneus brevis ist ein stärkerer Evertor als der M. peroneus longus und wesentlicher Antagonist des M. tibialis posterior (Abbildung 19), 20. Er scheint zudem eine Rolle bei der Verhinderung von Außenrotationsverletzungen des Unterschenkels über dem Fuß zu spielen. Er ist in etwa zeitgleich mit dem M. peroneus longus aktiv 21.
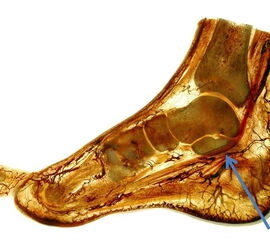
Der M. flexor hallucis longus ist während der späten Standphase aktiv und der wichtigste aktive Großzehenbeuger während dies passiv durch die Plantarfaszie erfolgt (siehe dort). Der M. flexor hallucis longus ist ein Plantarflector und Invertor. Er hat Anteil am Windlass-Mechanismus (siehe dort) (Abbildung 20).
Der Triceps surae-Komplex kontrolliert die Rotation und sorgt für eine kräftige Abstoßung. Er ist der stärkste Invertor am Rückfuß, kann aber anscheinend auch zu Beginn der Standphase bei varischem Rückfuß an der Eversion teilhaben 21. Der M. soleus hat eine ähnliche Kraftrichtung wie der M. gastrocemius. Der mediale Anteil des Gastrocnemius erscheint deutlich kräftiger als der laterale Anteil. Die Hauptaktivität des M. soleus findet sich bei ca. 70 % des Standzyklus, während der mediale M. gastrocnemius bei ca. 60% und der laterale M. gastrocnemius bei ca. 65% des Standzyklus Ihre Hauptaktivität im EMG zeigen 21.
Zur Biomechanik der Gelenke
Die Bewegungsachse des oberen Sprunggelenks verläuft etwas unterhalb der Malleolenspitzen. Damit läuft die Achse in der Transversalebene nach dorsal und lateral und in der Koronarebene um bis zu 100° nach lateral distal (Abbildung 21), (Inman 1991) . Nach Inman liegt die Achse des kegelförmigen Talus auf dieser Bewegungsachse. Dadurch wird sichergestellt, dass während der Bewegung möglichst kein Kontaktflächenverlust resultiert (Abbildung 22).
Die schräge Gelenkachse führt dazu, dass der Fuß nach dem Aufsetzen der Ferse eine Einwärtsbewegung vollführt (Abbildung 23). In der initialen Standphase ist der Fuß dann am Boden fixiert während der Unterschenkel über den Fuß läuft (Extensionsbewegung) und es kommt zur Innenrotation der Tibia und des Talus (Abbildung 23 und 24). Beim Abstoßen kommt es dann zu einer Plantarflexion und der Unterschenkel kann nach außen rotieren. Eine weitere Rotation führt dann über ein Anspannen der Sprunggelenksbänder zu einer Abduktion/Außenrotation des Talus (siehe oben) (Abbildung 23, 24 und 25) (Video 3), 11. Nach der Theorie von Inman kommt es damit zur knöchernen Verblockung beim Abstoßen 11, (Inman 1991).
Abb.23 - Abb.25: Dr.-Ing. Frank Layer, Dr. Ing. Klaus Sander (Biomechanik-Labor des Lehrstuhls für Orthopädie der Friedrich-Schiller-Universität Jena)
Video 3: Zeitlupenaufnahme eines physiologischen Gangzyklus. (Zu Beachten sind die Rotation des Unterschenkels und die Abduktion im Rückfuß, siehe dazu auch Tabelle 1)
Video 3: Dr. med. Christina Müller, Hardy Hauk, Lehrstuhl für Orthopädie der Friedrich-Schiller-Universität, Jena

Das Tibio-Fibular-Gelenk wird durch die Syndesmose stabilisiert (siehe oben) Auf Grund der trapezoidalen Form der Trochlea tali kommt es bei Dorsalextension zu einer maximalen Anspannung der Syndesmose und damit Stabilität in der Gelenkgabel. Die Bewegung der Fibula während eines Bewegungszykluses im Sprunggelenk wird je nach Autor mit einer Rotation von -1 bis 2°, einer Distalbewegung von 0 bis 4 mm und einem Auseinanderweichen der Malleolengabel von 0 bis ca. 3 mm beschrieben 2223242524 . Bozkur et al. ermittelten am Kadavermodel eine Lateralisation der Fibula bei Dorsalextension und ein mediales Abweichen bei Plantarflexion in fast allen Proben 24 Ahl et al. zeigten an einem unbelasteten Modell auf, dass sich die Fibula mit der Dorsalextension im OSG nach lateral und posterior bewegt 26 .Hinsichtlich der Rotationsbewegungen liegen verschiedene Studien vor, die bei Extension sowohl Innen- als auch Außenrotationen beschreiben. 2425 Auch bezüglich einer Distalisierung bestehen Kontroversen. Nach Scranton et al. kommt es mit der Kontraktion der Flexoren in der Standphase zu einer Abwärtsbewegung der Fibula zur Tibia mit daraus resultierender Anspannung der Syndesmose. Andere Autoren konnten eine derartige Bewegung nicht nachweisen 242527.
Das Subtalargelenk ist in zwei Kammern geteilt. Beide Kammern weisen eigene Kapseln auf und werden vom Ligamentum talocalcaneare interosseum getrennt. In der vorderen Kammer artikuliert der sphärische Taluskopf, medial auf dem Pfannenband sitzend, mit der vorderen und mittleren Facette des Calcaneus (facies articularis talaris anterior und media) und dem Os naviculare. Diese Strukturen werden auch als „acetabulum pedis“ beschrieben. Die hintere Kammer bildet die hintere Facette des Calcaneus (facies articularis talaris posterior) und die posterior-inferiore Facette des Talus (facies articularis calcanea posterior). Die Gelenkflächen sind zylindrisch, wobei der Kalkaneus in der vorderen Kammer konkav und der hinteren Kammer konvex geformt ist. Auf Grund der komplexen Gelenkgeometrie ist die Beweglichkeit des Subtalargelenks schwer zu beschreiben. Näherungsweise wird die Gelenkachse am ehesten als schraubenförmig oder helixartig beschrieben und zeigt einige Variationen (Inman 1991 , Klein und Sommerfeld 2004). Sie verläuft schräg von plantar lateral nach dorsal medial durch den Sinus tarsi, der als Drehpunkt fungiert (Abbildung 26). Bewegungen um diese Achse werden als Inversion/Eversion bezeichnet (Video 2). Vereinfachend kann für das untere Sprunggelenk von einer Eversionsbewegung beim Aufkommen der Ferse ausgegangen werden. Die Eversion erreicht ihr Maximum, wenn der Fuß flach am Boden aufliegt und wird beim Abstoßen in eine Inversion überführt. Auch wenn das Modell des Kardangelenks mit Drehpunkt im Sinus tarsi zur Beschreibung des Rückfußes mittlerweile umstritten ist, bedingen sich die Bewegungen aller am Gangzyklus beteiligten Gelenke, dabei leiten sich vor allem Rotationsbewegungen im Unterschenkel in Bewegungen am Subtalargelenk fort und umgekehrt (Coughlin et al. 2007 , Klein und Sommerfeld 2004 , Kummer 2005) . Diese Rotationsbewegungen werden wiederum durch die Stellung im oberen Sprunggelenk entscheidend beeinflusst. So kann der Unterschenkel bei Dorsalextension deutlich einfacher rotieren als bei Plantarflexion (Klein und Sommerfeld 2004).
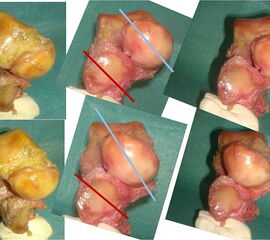
Das Chopart-Gelenk markiert den Übergang von Rück- zu Mittelfuß. Das Talo-navikulare Gelenk entspricht einem Kugelgelenk, das Calcaneo-cuboidal-Gelenk zeigt einen gegenläufigen Schwung. Beide Gelenkanteile haben für sich gesehen unterschiedliche Bewegungsausmasse und sind funktional aber als Gelenkkomplex zu verstehen und bilden eine funktionelle Einheit mit dem unteren Sprunggelenk. Elftman stellte eine Beziehung zwischen den Gelenkachsen des Chopartgelenks und der Stellung des Calcaneus her (Abbild 27, Video 3) 28 Demnach stehen die Gelenkachsen Talo-navikular-Gelenk und Calcaneo-cuboidal-Gelenk parallel wenn der Calcaneus evertiert steht, was die Beweglichkeit im Chopartgelenk frei gibt. Dies spielt beim Sohlenauftritt eine Rolle und ermöglicht dem Fuß eine flexible Anpassung an den Untergrund im Sinne einer Stoßdämpfung. Bewegt sich der Calcaneus beim Abstoßen (Video 2) in Inversion so verschieben sich nach Elftman die Gelenkachsen gegeneinander und das Charcot-Gelenk blockiert und stabilisiert den Fuß. Damit kann ein festes Abstoßen ohne Kraftverlust erreicht werden. 28 Das Prinzip entspricht dem Windlass-Mechanismus (s.o.) und hat unmittelbare klinische Relevanz bei der Einstellung von Rückfußarthrodesen.
Video 4: Bei Pronation im Vorfuß kommt es zu einer Verblockung der mechanischen Kette
Video 4: Dr. med. Christina Müller, Hardy Hauk, Lehrstuhl für Orthopädie der Friedrich-Schiller-Universität, Jena
Die Gelenke zwischen Os naviculare, Ossa cuneiformia und Os cuboideum werden gemeinhin als Amphiarthrosen betrachtet, weisen aber nach Ouzounian und Shereff eine Beweglichkeit von ca. 5° Extension / Felxion bzw. Pronation / Supination auf 29. Die Ossa cuneiforme 2 und 3 sowie die Basis des Meatarsale 2 spielen im statischen Schlusstein-Modell eine tragende Rolle (in der Architektur ist der Schlusstein ein keilförmige Stein am höchsten Punkt eines Gewölbes oder eines Bogens durch den die Konstruktion sich selbst trägt) (Abbildung 28 und 29).
Das Lisfranc-Gelenk ist bogenförmig aufgebaut und stark verzahnt. Dabei ist das Metatarsale II fest in die Ossa cuneiformia eingebettet und hat Anteil am Schlussstein-Modell (s.o.). Die Beweglichkeit entspricht vereinfacht Klaviertasten und ist am 5. Metatarsale am größten, gefolgt vom Metatarsale 1. Die geringste Beweglichkeit findet sich erwartungsgemäß am 2. Metatarsale. Daraus ergibt sich auch nach De Doncker und Kowalski und in Anbetracht pedobarographischer Untersuchungen eine statische intermediäre Säule aus Metatarsale II und III die fest am Boden aufliegen, während Metatarsale I und IV als dynamische mediale und laterale Säulen eine Verwringung des Mittelfußes und damit eine Anpassung der Metatarsaleköpfchen an den Untergrund erlauben (Abbildung 30) 30 . Die physiologische Beweglichkeit des ersten Metatarsale wird mit einer Auslenkung von etwa 5-15° in allen Ebenen angegeben und durch den M. peroneus longus beeinflusst (s.o.). Die Beweglichkeit des Metatarsale V entspricht in etwa 10 – 15° 1929 Durch die Verspannung des Fußes mit den plantaren Bändern und der Muskulatur werden evtl. Biegemomente umgewandelt (s.o. Windlass-Mechanismus und Abbildung 14), somit resultieren vor allem Druckbelastungen auf die Metatarsale und die Fußwurzel.
Die Zehengrundgelenke sind morphologisch Kugelgelenke. Das Großzehengrundgelenk übernimmt einen wesentlichen Anteil der Kraftübertragung bei der Abrollphase und ist stark am Windlass-Mechanismus beteiligt (s.o.) während die Kleinzehengrundgelenke eher dem Einkrallen in weichen Boden dienen.
Danksagung:
Die Autoren danken Frau Dr. med. Rosemarie Fröber, Oberärztin am Institut für Anatomie I und Kustos der Anatomischen Sammlung der Medizinischen Fakultät der Friedrich-Schiller-Universität Jena, für die anatomischen Bilder, Herrn Dr.-Ing. Frank Layher und Herrn Dr.-Ing. Klaus Sander, Biomechanik-Labor des Lehrstuhls für Orthopädie der Friedrich-Schiller-Universität Jena, für die Zurverfügungstellung der Ganganalysen und Frau Dr. med. Christina Müller sowie Herrn Hardy Hauk, Lehrstuhl für Orthopädie der Friedrich-Schiller-Universität Jena, für die Videos.
Der Beitrag wurde am 07.12.2013 veröffentlicht.
Weitere Literatur
- Ahl T, Dalen N, Lundberg A, Selvik G. 1987. Mobility of the ankle mortise. A roentgen stereophotogrammetric analysis. Acta Orthop Scand, 58 (4):401-402.
- Basmajian JV, Stecko G. 1963. The Role of Muscles in Arch Support of the Foot. J Bone Joint Surg Am, 45:1184-1190.
- Bozkurt M, Tonuk E, Elhan A, Tekdemir I, Doral MN. 2008. Axial rotation and mediolateral translation of the fibula during passive plantarflexion. Foot Ankle Int, 29 (5):502-507.
- Coughlin MJ, Mann RA, Saltzman CL. 2007. Surgery of the Foot and Ankle. Philadelphia: Mosby Elsevier.
- Davis WH, Sobel M, DiCarlo EF, Torzilli PA, Deng X, Geppert MJ, Patel MB, Deland J. 1996. Gross, histological, and microvascular anatomy and biomechanical testing of the spring ligament complex. Foot Ankle Int, 17 (2):95-102.
- De Doncker E, Kowalski C. 1970. [The normal and pathological foot. Concepts of anatomy, physiology and pathology of foot deformities]. Acta Orthop Belg, 36 (4):386-551.
- Elftman H. 1960. The transverse tarsal joint and its control. Clin Orthop, 16:41-46.
- Espinosa N, Smerek JP, Myerson MS. 2006. Acute and chronic syndesmosis injuries: pathomechanisms, diagnosis and management. Foot Ankle Clin, 11 (3):639-657.
- Hicks JH. 1954. The mechanics of the foot. II. The plantar aponeurosis and the arch. J Anat, 88 (1):25-30.
- Hunt AE, Smith RM, Torode M. 2001. Extrinsic muscle activity, foot motion and ankle joint moments during the stance phase of walking. Foot Ankle Int, 22 (1):31-41.
- Huson A. 1965. L'articulation calcaneo-cuboidienne. CR Assoc Anatomy 50:540-547.
- Imhoff AB, Linke R, Baumgartner R. 2006. Checkliste Orthopädie.
- Inman VT. 1991. The Joints of the Ankle. Baltimore: Williams & Wilkins.
- Inman VT, Ralston HJ, Todd F. 1981. Human Walking. Baltimor.
- Johnson CH, Christensen JC. 1999. Biomechanics of the first ray. Part I. The effects of peroneus longus function: a three-dimensional kinematic study on a cadaver model. J Foot Ankle Surg, 38 (5):313-321.
- Kato T. 1995. The diagnosis and treatment of instability of the subtalar joint. J Bone Joint Surg Br, 77 (3):400-406.
- Kitaoka HB, Luo ZP, Growney ES, Berglund LJ, An KN. 1994. Material properties of the plantar aponeurosis. Foot Ankle Int, 15 (10):557-560.
- Klein P, Sommerfeld P. 2004. Biomechanik der menschlichen Gelenke. Urban und Fischer.
- Kokubo T, Hashimoto T, Nagura T, Nakamura T, Suda Y, Matsumoto H, Toyama Y. 2012. Effect of the posterior tibial and peroneal longus on the mechanical properties of the foot arch. Foot Ankle Int, 33 (4):320-325.
- Kramers-de Quervain IA, Stussi E, Stacoff A. 2008. Ganganalyse beim Gehen und Laufen. Schweizerische Zeitschrift für Sportmedizin und Sporttraumatologie, 56 (2):35-42.
- Kummer B. 2005. Biomechanik. Köln: Deutscher Ärzte-Verlag.
- Kura H, Luo ZP, Kitaoka HB, Smutz WP, An KN. 2001. Mechanical behavior of the Lisfranc and dorsal cuneometatarsal ligaments: in vitro biomechanical study. J Orthop Trauma, 15 (2):107-110.
- Lapidus PW. 1943. Misconception about the "Springiness" of the longitudinal arch of the foot. Arch Surg, 46:410-421.
- Lofvenberg R, Karrholm J, Selvik G. 1990. Fibular mobility in chronic lateral instability of the ankle. Foot Ankle, 11 (1):22-29.
- Niethardt F, Pfeil J, Bieberthaler P. 2009. Orthopädie und Unfallchirurgie Thieme.
- Norkus SA, Floyd RT. 2001. The anatomy and mechanisms of syndesmotic ankle sprains. J Athl Train, 36 (1):68-73.
- Otis JC, Deland JT, Lee S, Gordon J. 2004. Peroneus brevis is a more effective evertor than peroneus longus. Foot Ankle Int, 25 (4):242-246.
- Ouzounian TJ, Shereff MJ. 1989. In vitro determination of midfoot motion. Foot Ankle, 10 (3):140-146.
- Rammelt S, Zwipp H, Grass R. 2008. Injuries to the distal tibiofibular syndesmosis: an evidence-based approach to acute and chronic lesions. Foot Ankle Clin, 13 (4):611-633, vii-viii.
- Rush SM, Christensen JC, Johnson CH. 2000. Biomechanics of the first ray. Part II: Metatarsus primus varus as a cause of hypermobility. A three-dimensional kinematic analysis in a cadaver model. J Foot Ankle Surg, 39 (2):68-77.
- Santilli V, Frascarelli MA, Paoloni M, Frascarelli F, Camerota F, De Natale L, De Santis F. 2005. Peroneus longus muscle activation pattern during gait cycle in athletes affected by functional ankle instability: a surface electromyographic study. Am J Sports Med, 33 (8):1183-1187.
- Sarrafian SK. 1983. Anatomy of the foot and ankle: Descriptive, topographic, functional. Philadelphia: Lippincott
- Sarsam IM, Hughes SP. 1988. The role of the anterior tibio-fibular ligament in talar rotation: an anatomical study. Injury, 19 (2):62-64.
- Scranton PE, Jr., McMaster JG, Kelly E. 1976. Dynamic fibular function: a new concept. Clin Orthop Relat Res, (118):76-81.
- Smith JW. 1958. The ligamentous structures in the canalis and sinus tarsi. J Anat, 92 (4):616-620.
- Solan MC, Moorman CT, 3rd, Miyamoto RG, Jasper LE, Belkoff SM. 2001. Ligamentous restraints of the second tarsometatarsal joint: a biomechanical evaluation. Foot Ankle Int, 22 (8):637-641.
- Sommer C, Hintermann B, Nigg BM, van den Bogert AJ. 1996. Influence of ankle ligaments on tibial rotation: an in vitro study. Foot Ankle Int, 17 (2):79-84.
- Stainsby GD. 1997. Pathological anatomy and dynamic effect of the displaced plantar plate and the importance of the integrity of the plantar plate-deep transverse metatarsal ligament tie-bar. Ann R Coll Surg Engl, 79 (1):58-68.
- Stephens MM, Sammarco GJ. 1992. The stabilizing role of the lateral ligament complex around the ankle and subtalar joints. Foot Ankle, 13 (3):130-136.
- Tochigi Y, Takahashi K, Yamagata M, Tamaki T. 2000. Influence of the interosseous talocalcaneal ligament injury on stability of the ankle-subtalar joint complex--a cadaveric experimental study. Foot Ankle Int, 21 (6):486-491.
- Xenos JS, Hopkinson WJ, Mulligan ME, Olson EJ, Popovic NA. 1995. The tibiofibular syndesmosis. Evaluation of the ligamentous structures, methods of fixation, and radiographic assessment. J Bone Joint Surg Am, 77 (6):847-856.